Seedetrakti mikrobioota omab immuunsüsteemis võtmerolli
Seedetrakti mikrobioota sisaldab üle 35 000 liigi baktereid ning miljoneid teisi mikroorganisme nagu viirused, seened, arhed ja algloomad[1]. See äärmiselt mitmekülgne kogukond eksisteerib enamasti oma peremehega kooskõlas ja võib mõjutada organismi toimimist[1].
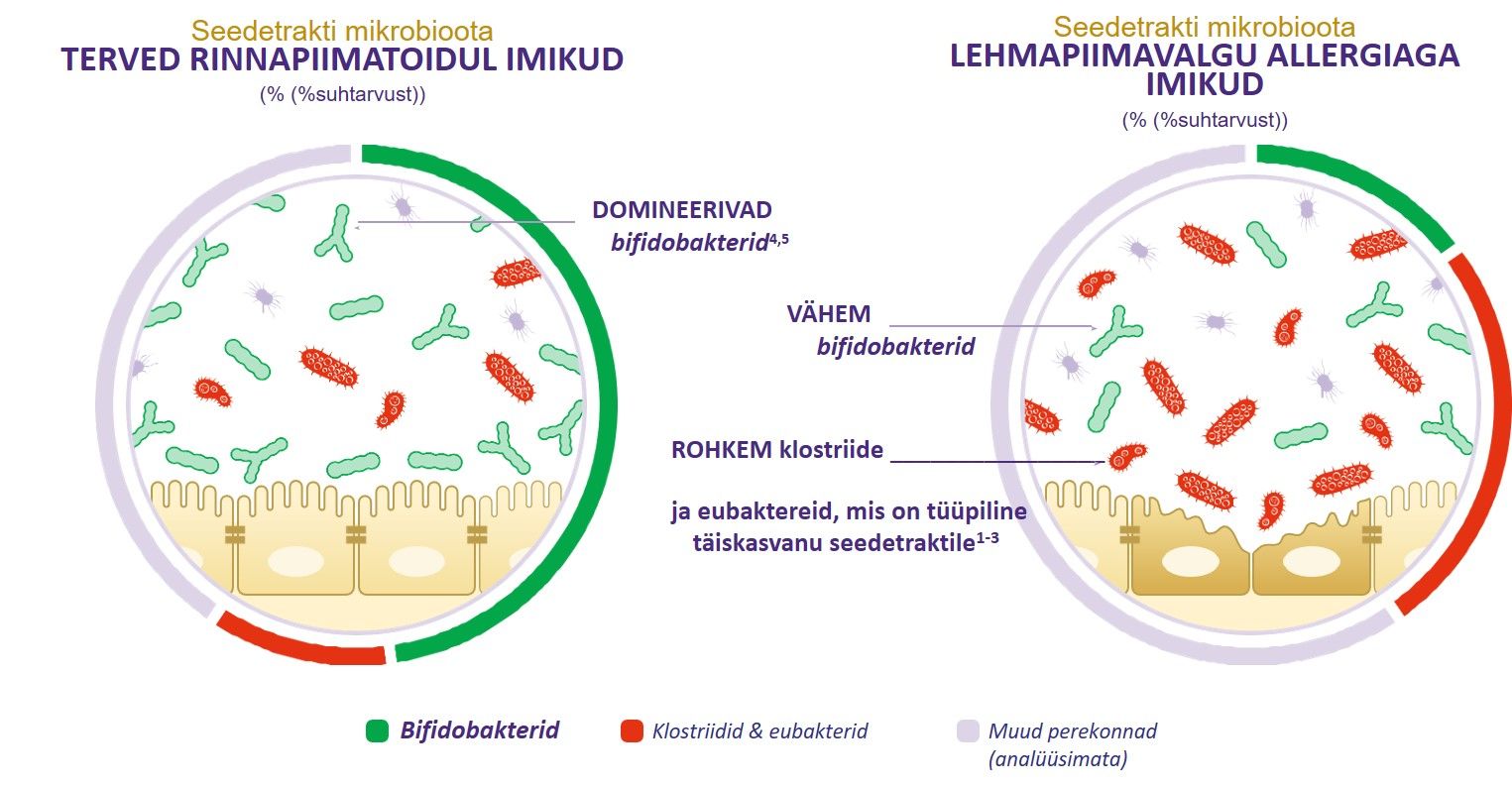
Terve ja tasakaalus seedetrakti mikrobioota aitab immuunsüsteemil kaitsta organismi patogeenide eest ja samas taluda ka muidu ohutuid aineid[2,3], nagu õietolm ja piimavalgud (nii et allergilisi reaktsioone ei teki üldse või need on tagasihoidlikud). Vastukaaluks – tasakaalust väljas seedetrakti mikrobiootat ehk seedetrakti mikrobioota düsbioosi seostatakse allergiate ja haigustega nagu astma, põletikulised soolehaigused, ekseem ja diabeet[4,5].
Tänaseks on olemas järjest enam tõendeid, et seedetrakti mikrobioota düsbioos varajases elueas on seotud toiduallergiate, sealhulgas lehmapiimavalgu allergia (LPA) tekkimisega[6,7]. Tervete imikutega võrreldes on LPa-ga imikutel seedetrakti mikrobioota tasakaalust väljas ja sisaldab vähem bifidobaktereid tasemeid[7].
1. Canani RB et al. ISME J. 2016;10(3):742–750. 2. Thompson-Chagoyan OC et al. Pediatr Allergy Immunol. 2010;21(2p2):e394–e400. 3. Candy DCA et al. Pediatr Res. 2018;83(3):677–686. 4. Harmsen HJ et al. J Pediatr Gastroenterol Nutr. 2000;30(1):61–67. 5. Scholtens PAMJ et al. J. Annu Rev Food Sci Technol. 2012;3(1):425–447
Hetkel ei ole selge, kuidas täpselt seedetrakti mikrobioota düsbioos on seotud toiduallergiate tekkega, kuid uuringud viitavad sellele, et seedetrakti mikrobioota mõjutab immuunsüsteemi, muutes organismi metabolismi ja immuunvastust [1,4]. Seega on võimalik, et LPA-ga imikud, kes on infektsioonidele vastuvõtlikumad[], vajavad lisaks allergiasümptomite tõhusale leevendamisele ka seedetrakti mikrobioota düsbioosi tasakaalustamist, sest düsbioosi seostatakse immuunsüsteemi kehvema toimimisega.
Varajane eluiga: seedetrakti mikrobioota arenemise võtmeperiood
Esimesed 1000 elupäeva moodustavad kriitilise ajaakna terve seedetrakti mikrobioota kujunemises[9]. Imiku seedetrakti mikrobioota muutub selle aja jooksul ja küpseb umbes kolmandaks aastaks[10-12].
Seedetrakti mikrobioota delitaaktse tasakaalu häirimine sellel tundlikul perioodil võib suurendada ohtu haigestuda mitte ainult imikueas vaid ka hilisemas elueas9. Varajases eas seedetrakti mikrobiootat mõjutavad faktorid on järgmised1 :
- Sünnituse viis. Vaginaalsel teel sündivad imikud puutuvad kokku erineva mikrobiootaga võrreldes keisrilõike teel sündivate imikutega ja see mõjutab nende seedetrakti bakteriaalset kooslust [13].
- Antibiootikumide kasutamine. Mõned uuringud on näidanud, et antibiootikumide kasutamine varajases eas muudab ja vähendab seedetrakti mikrobioota mitmekesisust [14].
- Keskkonnafaktorid. Usutavasti mõjutavad seedetrakti mikrobioota kooslusi nii tarbimise kui sissehingamise kaudu toimuvad kokkupuuted kemikaalide ja saasteainetega [15-17].
- Toitumine varajases eas. Toitumine esimestel elukuudel mängib olulist rolli seedetrakti mikrobioota kujunemises ja võib mõjutada allergiate tekket [18].
Toitumine varajases eas ja seedetrakti mikrobioota tervis
Rinnapiim on imikutele parim toit, mis sisaldab kõiki normaalseks kasvuks ja arenguks vajalikke toitaineid ja suudab mõjutada ka terve seedetrakti mikrobioota kujunemist. See toimub kasulike bakterite (nt bifidobakterid), aga ka süsivesikute – oligosahhariidide abil, mis soodustavad kasulike bakterite kasvu [19-21].Piimaseguga toidetavate imikutega võrreldes domineerivad rinnapiimatoidul imikute seedetrakti mikrobiootas bifidobakterid [9].
Juhul, kui imik ei saa ainult rinnapiima, siis võib seedetrakti mikrobiootat toetav piimasegu olla abiks tasakaalus seedetrakti mikrobioota kujunemisele ja seega panustada nende laste lühi- ja pikaajalisse tervisesse [19-22].
1. Jandhyala SM et al. World J Gastroenterol. 2015: 21(29); 8787–803.
2. Azad M, et al. Clin Exp Allergy 2015;45:632–43.
3. Kirjavainen P, et al. Gut 2002;51:51–5.
4. Valdes AM et al. BMJ 2018; 361: k2179.
5. Frati F et al. Int. J. Mol. Sci. 2019: 20; 123–34.
6. Lee et al. Clin Mol Allergy 2020: 18; 5–15.
7. Dong P et al. Saudi J Biol Sci. 2018: 25; 875–80.
8. Woicka-Kolejwa et al. 2016 (independent study)
9. Robertson RC et al. Trends Microbiol. 2019; 27(2): 131–47.
10. Wopereis H, et al. Pediatr Allergy Immunol, 2014;25:428-38
11. Scholtens PA, et al. Annu Rev Food Sci Technol, 2012;2:425-47
12. Arrieta MC, et al. Front Immunol, 2014;5:427
13. Neu J, et al. Clin Perinatol, 2011 ;38(2) :321-31
14. Ahmadizar F, et al. Pediatr Allergy Immunol, 2017;28(5):430-7
15. Patel MM, et al. Environ Res, 2011;111(8):1222-29
16. Ryan PH, et al. J Allergy Clin Immunol, 2005;116(2):279-84
17. Ryan PH, et al. Am J Respir Crit Care Med, 2009;180(11):1068-75
18. Berni Canani R, et al. Front Immunol, 2019 ;10 :191
19. Walker WA, et al. Pediatr Res. 2015; 77(1–2): 220–8.
20. Bergmann H, et al. British J Nutr. 2014; 112: 1119–28.
21. Hunt KM, et al. PLoS One 2011; 6(6): e21313.
22. Chua M, et al. JPGN 2017; 65: 102–6.